Inseminación artificial, objetivo cumplido
Publicado el
por Gabriela.
AUTOR: Fabián M. Gerpe Meirás
INTRODUCCIÓN
La inseminación artificial en canarios no será una técnica mayoritaria en un futuro, o al menos eso creo, pero nos brindará una alternativa para solucionar problemas que con la inseminación natural, a través de la cópula entre macho y hembra, no somos capaces de hacerlo. Por ejemplo, en aquellas parejas incompatibles socialmente, porque se pelean constantemente, no copulan, pero que sería muy interesante realizar ese cruce por su gran aporte genético.
Los datos y fotografías que muestro en este artículo son de canarios Cantor Español, pero que entiendo que son válidos para el resto de canarios, o al menos para la mayoría de ellos.
No soy científico, aunque si un poco aficionado a la ciencia, a la que, de vez en cuando, me dedico, entre otras cosas, en mis ratos libres. No obstante, la mayoría de mi tiempo libre se lo dedico a los pájaros de canto y a lo que rodea a estos.
INSEMINACIÓN ARTIFICIAL EN CANARIOS OBJETIVO CUMPLIDO
Empecé el trabajo para lograr la inseminación artificial en canarios en el año 2012, sin apenas información.
Tenía que conseguir extraer semen a un canario macho e introducirlo en la vagina de la hembra. Quería documentar el proceso lo mejor posible. Pero se me presentaban varias incógnitas. ¿Cómo saber si he obtenido semen y no orina y heces? ¿Qué aspecto tenía un espermatozoide? ¿Qué tamaño tenía un espermatozoide? ¿Sería adecuado mi microscopio o necesitaba otro microscopio con más aumentos para verlo?
Había visto algunos vídeos que nos muestran cómo extraer el semen al macho y posteriormente inseminar, pero la rigurosidad del proceso dejaba mucho que desear. No aportaban comentarios de que dicha inseminación diese como resultado huevos fecundados, al menos los que yo he podido ver. Sólo uno de esos videos, que podemos ver en YouTube, el autor nos cuenta en los comentarios que la inseminación no fue positiva. Lo único que había conseguido utilizando estas técnicas que vi en los videos ha sido hacer daño al macho.
Así que, tomé como base la información que había obtenido sobre la inseminación en gallinas, que no me dejaba dudas de su rigurosidad.
El primero objetivo, era obtener una muestra en la que se pudiese ver espermatozoides. Para ello, buscaba pequeñas células que se desplazasen moviendo la cola o flagelo. Pues eso hice durante la temporada de cría de 2012, sin llegar a ver ninguna célula de ese tipo, incluso probando con una lente en el microscopio de x100.
En el año 2013, encuentro un artículo del año 1975 publicado en la revista “Pájaros”, escrito por Alfonso Babra, que habla del tema, pero tampoco me aporta mucho a mi búsqueda de espermatozoides.
Casi finalizada la temporada de cría de 2013, sin mucha fortuna en la búsqueda, me encuentro con el trabajo del Dr. Griñan, que habla de inseminación artificial en canarios obteniendo los espermatozoides a través de cirugía endoscópica. En ese trabajo, expone algunas fotos de los espermatozoides. Ver imagen 1.
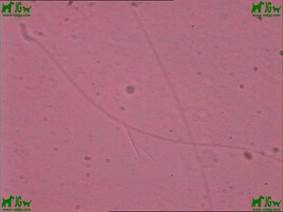
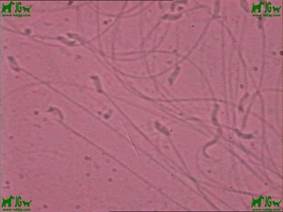
Imagen 1 – Espermatozoides canario fotografías Dr. Griñan
Para mí fue una gran alegría, jamás había visto un espermatozoide de canario, pero ahora ya sabía lo que buscaba, no sabía su tamaño, pero al menos tenía una buena pista a seguir.
Con la temporada de cría prácticamente terminada, para intentar ver un espermatozoide lo que hice fue meter a un macho con la hembra, esperar la cópula, y obtener una muestra de los fluidos de ambos pájaros para ver si esas muestras contenían espermatozoides. Esto es lo que encontré, ver imagen 2.
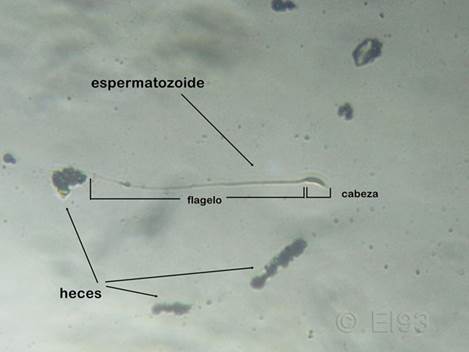
Imagen 2 – Espermatozoide degradado a 460 aumentos
En la temporada de cría de 2014 retomé la búsqueda de espermatozoides vivos basándome en las fotos del Dr. Grinán.
Pero los espermatozoides que buscaba no aparecían. Hasta que un día un buen amigo me pone en contacto con Agustín, un veterinario jubilado, que había trabajado en la inseminación de canarios, quién me orienta sobre cómo se presentan los espermatozoides y me advierte de que son diferentes a los de los mamíferos. Toda mi búsqueda da un vuelco, porque recuerdo haber visto unas células como me describió Agustín, pero que en su día di por hecho que eran células presentes en las heces, y no espermatozoides, al no utilizar el flagelo para moverse.
A finales de la temporada de cría 2014, puedo confirmar que he obtenido espermatozoides. Realizo varias recolecciones de semen y en la mayoría de las muestras allí estaban presentes, por lo que, en ese momento, considero que la técnica de recolección es adecuada y funcional. Ver imagen 3.
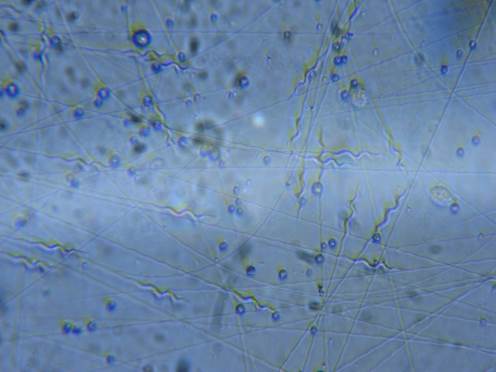
Imagen 3 – Espermatozoides a 460 aumentos
¿Pero entonces los espermatozoides que muestran las fotografías del Dr. Griñán no son espermatozoides? Si, lo son.
¿Pero el aspecto es diferente? Cierto. Voy a intentar explicar el porqué. He visto que si mantenemos el esperma en el porta muestras varios minutos, los espermatozoides se empiezan a descomponer y se rompen por la mitad de la cabeza, pasados más minutos (1 ó 2 horas) la cabeza se separa del flagelo por completo. Las fotos del Dr. Griñan, intuyo que fueron obtenidas en el proceso de deterioro del esperma, pasados más de 30 minutos después de obtener la muestra. Ver imagen 4.
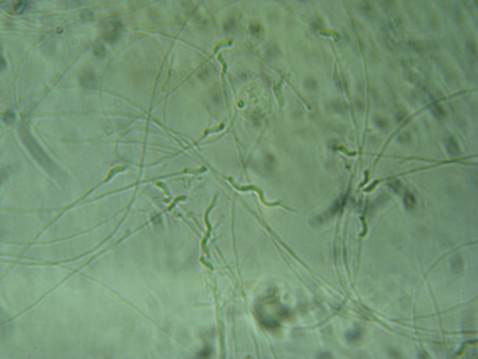
Imagen 4 – Espermatozoides en descomposición a 460 aumentos
Tras 4 años persiguiendo la inseminación artificial en el canario Cantor Español, por fin en el año 2015, consigo el objetivo. Voy a intentar explicar cómo lo he hecho…
MATERIAL UTILIZADO
Este es el material que yo he utilizado para realizar todo el proceso de inseminación. Pero podemos utilizar otros materiales que nos permitan realizar la misma función. Aunque durante estos años de pruebas he probado con otros materiales, estos son los que considero más adecuados teniendo en cuenta su bajo coste económico.
Pipeta de Pasteur: Podemos utilizar las de vidrio o las de plástico de punta fina. Si utilizamos las de vidrio, debemos reducir la sección de la punta para una mejor recolección del semen, y acoplarle una tetina que perforaremos nosotros mismos de forma sencilla. En el siguiente vídeo muestro como reducir la sección de la pipeta. Si utilizamos las de plástico de punta fina no es necesario realizar ninguna modificación, porque ya viene con tetina incorporada que debemos perforar. Las pipetas se pueden reutilizar, pero es necesario limpieza adecuada. La pipeta de vidrio es más duradera, ya que soporta la limpieza muy bien. La de plástico de punta fina, no es tan duradera porque la punta es flexible y se deteriora con las limpiezas.
Microscopio: Para ver la calidad del semen es necesario un microscopio. Un microscopio sencillo, de los que se utilizan para uso educativo es suficiente para ver los espermatozoides. Este tipo de microscopios suelen venir con lentes de X10 o X16 en el visor, y 4x, 10x y 40x en el revólver.
Aunque que algunas de las imágenes que veréis en este artículo están obtenidas con un microscopio NIKON Mod. Eclipse E400 que cuenta con contraste de fases. La mayoría de las imágenes fueron obtenidas con un microscopio Bresser Biolux NV.

Imagen 5 – Microscopio Bresser Biolux NV
Cámara de Neubauer:Para determinar el tamaño de los espermatozoides he utilizado una cámara de Neubauer, que tiene sectores micrométricos que nos permite obtener una referencia métrica bajo el microscopio.

Imagen 6 – Porta muestras con cámara de Neubauer
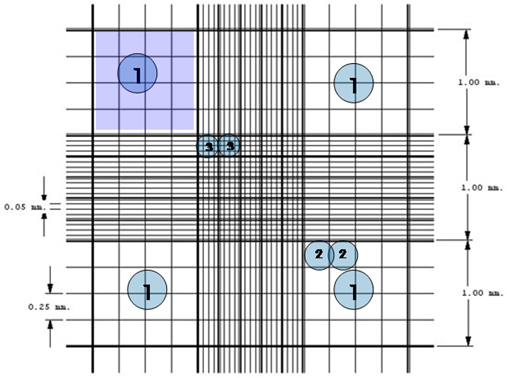
Imagen 7 –Distancias cámara de Neubauer

Imagen 8 –Divisiones cámara de Neubauer
Paciencia: Debemos conservar la paciencia ya que, sobre todo al principio, no resultará del todo fácil recolectar el semen en buenas condiciones. Pero como todo en cualquier actividad de la vida, necesitaremos coger práctica y adquirir experiencia.
RECOLECCIÓN DEL SEMEN
La recolección de semen del macho de canario, si este no está excitado, resulta una operación muy complicada. De hecho, bajo mi punto de vista, es la operación más complicada de todo el proceso de inseminación. Me refiero a obtener semen con un mínimo de propiedades, para que la inseminación cuente con algunas posibilidades de éxito. En los múltiples intentos de recolección de semen que he realizado, si el macho no estaba excitado, el resultado era siempre negativo. Siempre ocurrían dos cosas o no obtenía nada de semen, o de obtener algo, siempre espermatozoides muertos junto con restos de heces.
La forma que mejor me ha funcionado para recolectar el semen del macho es la siguiente:
1.- El macho debe estar entrado en celo claramente.
2.- No estar con ninguna hembra en las últimas 24 horas. Aunque este punto no es determinante para obtener semen, si he observado que la cantidad de líquido seminal aumenta si el macho no está con la hembra.
3.- Nos acercamos a la jaula del macho, este se pondrá un poco nervioso, o en alerta, por ver nuestra presencia muy cercana a su jaula, defecará una o dos veces. Es importante que defeque antes de extraer el semen, para evitar la contaminación de este con las heces. En muchas ocasiones los machos también defecan en el paso posterior estando ya con la hembra, pero si podemos conseguir que lo haga en su jaula antes de meterlo con la hembra mejor.
4.- Cogemos al macho y lo metemos con una hembra, en este momento es cuando el macho puede defecar, pero como no siempre lo hace, es mejor asegurarnos de que lo ha hecho antes. Esperamos a que el macho le cante a la hembra con intención de cópula, y en ese momento, lo retiramos para realizar la recolección. No dejaremos que la cópula se produzca.
5.- Cogemos el macho, lo ponemos boca abajo, lo sujetamos con una mano, con los dedos índice y pulgar de la misma mano con la que sujetamos el pájaro, presionamos lateralmente la cloaca del macho de forma suave. Veremos como brota un líquido que recogeremos con la pipeta, que sujetamos con la otra mano, por capilaridad, sin chupar, simplemente dejamos que el líquido siga el camino que le ofrece la punta de la pipeta. No introducir demasiado la punta de la pipeta, solo un par de milímetros, debemos pensar que el líquido está alojado debajo del labio copulador. Este líquido es el líquido seminal o esperma, si hemos hecho bien el proceso debería brotar limpio, sin heces u orina. El color del líquido recolectado, el esperma, varía en función de la concentración de espermatozoides presente en él, desde transparente, a color canela o pardo.

Imagen 10 – Labio copulador del macho
La recolección ideal sería un líquido seminal de color canela, con espermatozoides de gran actividad o movimiento.
No siempre se puede conseguir la excitación máxima del macho en el momento preciso que tenemos programada la inseminación. Los canarios no dejan de ser seres vivos y como tales, tienen estados de ánimo que varían según las circunstancias.
Aunque la mejor forma que considero, para recolectar el semen, es metiendo el macho con la hembra unos segundos, sin dejar que copulen, lo hago de forma genérica. Lo que quiero decir es que, de forma genérica, esa es la que considero mejor. Ahora bien, los 8 machos con los que trabajado me han demostrado que cada uno tiene su carácter. De esos 8 machos alguno era muy complicado excitarlo porque se asustaba fácilmente, otros con solo ver a la hembra se excitaban, incluso había uno de ellos, que con dejarlo varios días 2 ó 3 días sin contacto visual con la hembra lo cogías directamente y en la gran mayoría de veces recolectabas una buena muestra. Resumiendo, que si conocemos bien a los machos, sabremos cuando será el momento idóneo para la recolección de semen.
Aunque el macho no se encuentre en su excitación máxima, también podemos recolectar el semen en cantidad y calidad suficientes para realizar la inseminación con posibilidades de éxito.
Sobre el procedimiento que considero ideal para la recolección de semen, podemos realizar variantes que, aunque han sido menos efectivas en cuanto a cantidad de semen, los resultados han sido aceptables.
Estas variantes pueden ser:
- Que no hayan pasado 24 desde que el macho ha estado con una hembra.
- Que el macho no llegue a cantar cuando lo metemos con una hembra.
- Que no metamos el macho con la hembra pero por el mero hecho de tener contacto visual o auditivo la excitación puede ser suficiente para obtener algo de semen.
Como he dicho anteriormente, podemos obtener semen en estas circunstancias, pero las probabilidades de obtenerlo en buenas condiciones son menores.
Como dice el refrán vale más una imagen que mil palabras, en el siguiente vídeo muestro como realizo la recolección de semen paso a paso.
EL SEMEN
Una vez recolectado el semen del macho, debemos asegurarnos de que el semen obtenido es de buena calidad. Para ello debemos valorar 3 parámetros:
- Volumen de líquido seminal.
- La cantidad de espermatozoides.
- La movilidad de los espermatozoides.
En las recolecciones de semen que he realizado el volumen medio recogido esta entre 0,02 ml y 0,04 ml.
Una forma de ver la concentración de espermatozoides en el líquido seminal es bajo el microscopio, donde veremos los espermatozoides y su concentración.
El número de espermatozoides por recolección, mejor dicho la concentración de espermatozoides por muestra, me fue imposible de cuantificar, porque no era capaz de contar los espermatozoides en la cámara de Neubauer, bajo el microscopio. La concentración de espermatozoides es tan alta, que no soy capaz de distinguir los individuos correctamente, ni para llegar a una cifra aproximada.

Imagen 11 – Masa espermatozoides en cámara de Neubauer a 160 aumentos
Podría diluir la muestra en un porcentaje conocido bajo el microscopio en la cámara de Neubauer, contar los espermatozoides y multiplicarlo por el porcentaje conocido de dilución, pero es algo que no he realizado.
Pero si tengo una forma de saber si una recolección de semen posee un número abundante de espermatozoides o no, por su color a simple vista. El líquido seminal de un canario en la pipeta de recolección, adquiere varias tonalidades en función de la concentración de espermatozoides, que va desde el color transparente al color pardo o canela, incluso distintas tonalidades de color pardo dentro del mismo líquido seminal. Las zonas de color pardo señalan las zonas de mayor concentración de espermatozoides.
Si el líquido es transparente, como si fuese agua, significa que la concentración de espermatozoides es baja. Si el líquido seminal adquiere un color canela, la concentración de espermatozoides es alta. Incluso dentro de una misma muestra recolectada, podemos ver partes con tonalidades canela y otras más transparentes. Los espermatozoides son microscópicos y no podemos verlos a simple vista, pero cuando están muy juntos, en un número grande de individuos, podemos apreciar los grupos que forman en forma de color canela o pardo.
Una muestra vista a con el ojo humano de color canela adquiere la visión bajo el microscopio como muestra la imagen 12. La muestra al ojo humano de color transparente se ve bajo el microscopio como vemos en la imagen 13.
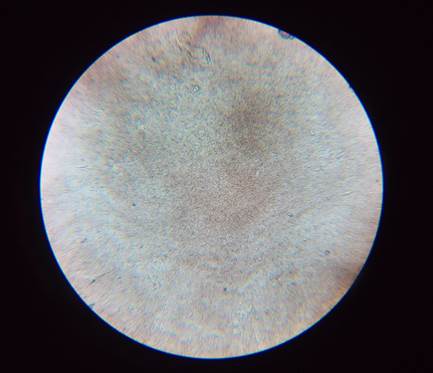
Imagen 12 – Población densa de espermatozoides limpia a 64 aumentos
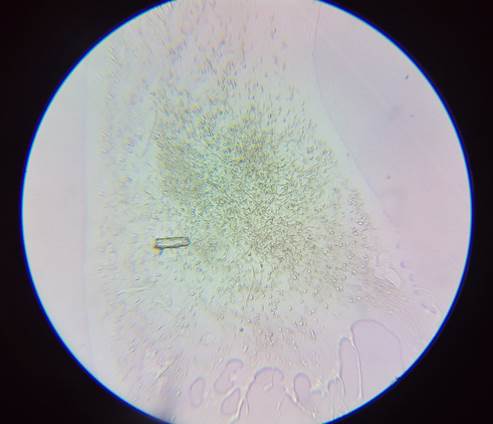
Imagen 13 – Población poco densa de espermatozoides a 64 aumentos
Si el líquido es blanco como la leche, o muy oscuro, no habrá dudas, son heces.
Para conocer bien las recolecciones, recomiendo observarlas al microscopio para que uno pueda familiarizarse con ellas.
Para ver la movilidad de los espermatozoides, no me ha quedado más remedio que hacerlo bajo el microscopio. Con un microscopio, de 160 a 640 aumentos, se puede ver perfectamente los espermatozoides de forma muy clara. Para observar la movilidad debemos enfocar la lente a zonas donde la concentración de espermatozoide no sea muy alta, ya que si enfocamos la lente hacia zonas muy masificadas de espermatozoides no veremos apenas movimiento. La razón es que están tan apelotonados que no tienen margen de maniobra en el porta muestras.
EL ESPERMATOZOIDE
Los datos e imágenes sobre los espermatozoides que mostraré a continuación corresponden a canarios Cantor Español, y aunque no he observado espermatozoides de otra raza de canarios, intuyo que compartirán las mismas características.
Tamaño espermatozoide
El tamaño aproximado de un espermatozoide es el siguiente:
Cabeza 16 micras
Flagelo 194 micras
Total 210 micras
El flagelo es unas 12 veces más largo que la cabeza
Para el canaricultor estas cifras serán suficientes para hacerse una idea de del tamaño de un espermatozoide, para un científico seguramente no sean todo lo rigurosas que deberían, por eso quiero hacer hincapié en que estas cifras son aproximadas. No obstante en la imagen 9 podemos ver un espermatozoide con una referencia métrica para que cada uno pueda hacer su propia medida.

Imagen 9 – Tamaño espermatozoide de un canario a 400 aumentos
Forma espermatozoide
En el espermatozoide se distinguen dos partes, la cabeza y el flagelo.
La cabeza tiene forma helicoidal, se asemeja a la punta de un sacacorchos.
El flagelo tiene forma longitudinal, se asemeja a un pelo liso o un látigo.
Movimiento espermatozoide
Los movimientos que realiza el espermatozoide son dos. Uno de los movimientos es rectilíneo, aunque no sea una recta perfecta, y hacia delante. Podemos denominar a este movimiento, movimiento de desplazamiento. El otro movimiento que realiza es un movimiento helicoidal, girando sobre sí mismo, emulando al giro de una broca de un taladro. Con este movimiento, consigue la impulsión necesaria para moverse hacia delante. Con el giro sobre sí mismo, consigue el mismo efecto que una hélice de un barco cuando gira, consigue fuerza de impulsión. Podemos denominar a este movimiento, movimiento de impulsión.
Si nos fijamos en el video podemos observar perfectamente los dos movimientos.
INSEMINACIÓN DE LA HEMBRA
Para la inseminación de la hembra he realizado siempre el mismo método pero con tres variantes. La razón de realizar variantes era hacer pruebas, para encontrar la mejor opción de inseminación, en términos de efectividad. La efectividad la mido en número de huevos fecundados en cada postura.
Primeramente he intentado localizar el oviducto, en el interior de la hembra, para introducir el semen por él, pero al ser un animal tan pequeño no he encontrado endoscopios económicos que me pudiesen ayudar. Pero por lo que intuyo tras las exploraciones realizadas con un endoscopio casero, me da la impresión de que el oviducto aumenta de tamaño cuando la hembra está en celo. Es decir, que el conducto del oviducto es de mayor tamaño en la hembra que el intestino grueso, bueno, al menos esa es mi impresión, sin tener la seguridad total de que es así realmente.
En la Tabla 1 podemos ver el resumen de todas las inseminaciones realizadas en la temporada de cría 2015, sin hacer distinción de las variantes utilizadas. En esta tabla están contabilizadas todas las inseminaciones, incluidas las de pruebas en busca de mejoras de efectividad.
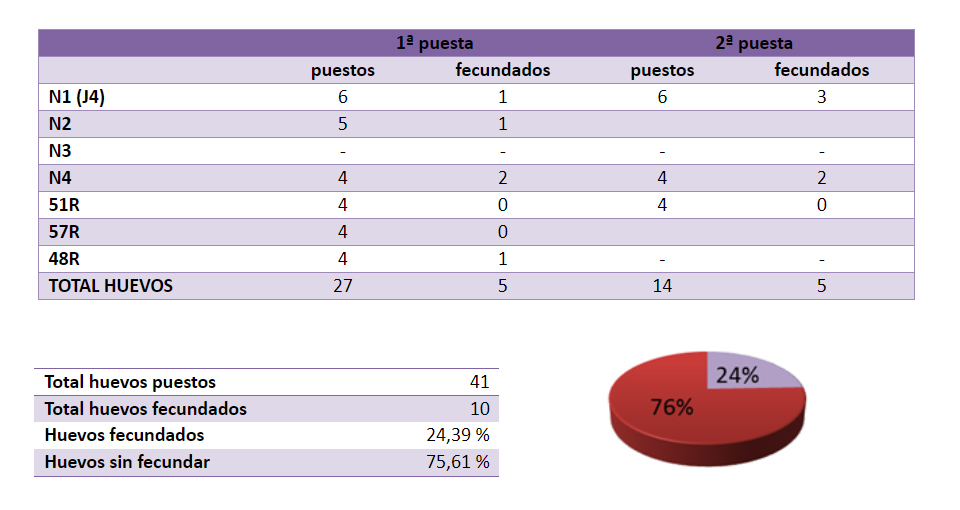
Tabla 1 – Total inseminaciones
Método general
Utilizando esa impresión, el proceso general para inseminar a la hembra es el siguiente:
Por supuesto la hembra debe estar bien encelada y preparada para poner huevos.
Lo siguiente es asegurarse de que la cloaca-vagina está limpia de heces. Si podemos hacer defecar a la hembra antes de la inseminación, mucho mejor, así evitaremos que defeque durante el proceso de inseminación.
Cogemos la hembra boca abajo con una mano, presionamos lateralmente y suavemente la cloaca-vagina de la hembra, con los dedos índice y pulgar de la misma mano con la que sujetamos a la hembra, para sacar al exterior una pequeña parte de la vagina. Una vez que se muestre exteriormente, con la pipeta en la otra mano, dejo caer la gota de esperma, dejo de presionar con los dedos índice y pulgar para que la vagina se retraiga y vuelva a posición normal. A continuación soplo un par de veces sobre la vagina con la propia pipeta, sin introducir aire en ella, para obligar a la hembra a realizar un par de contracciones. El motivo de que la obligue a realizar estas contracciones es para que el semen se vaya hacia el interior del oviducto y evitar que la hembra lo expulse. Ver video.
En ningún momento he introducido ningún objeto en el interior de la hembra.
Variante 1
Llamaré variante 1 al siguiente proceso, que podemos denominar prepostura. Siguiendo el método general, realizo la inseminación directamente. Es decir, una vez que extraigo el semen y compruebo su calidad, insemino a la hembra con ese semen, a los pocos minutos de la recolección, 2 ó 3 minutos máximo. La inseminación tiene lugar los días en los que la hembra está construyendo el nido. Como fecha límite para la inseminación, tomo un día antes de que la hembra ponga el primer huevo. Los mejores resultados los he tenido inseminando entre 4 y 2 días antes de que la hembra ponga el primer huevo. Ver tabla 2. En las 2 últimas posturas con inseminación por esta variante, he marcado los huevos según su orden en la postura (hembras 48R y N4). El huevo fecundado de 48R fue el 3º según orden de postura, y de N4 fueron el 2º y 3º según su orden de postura.
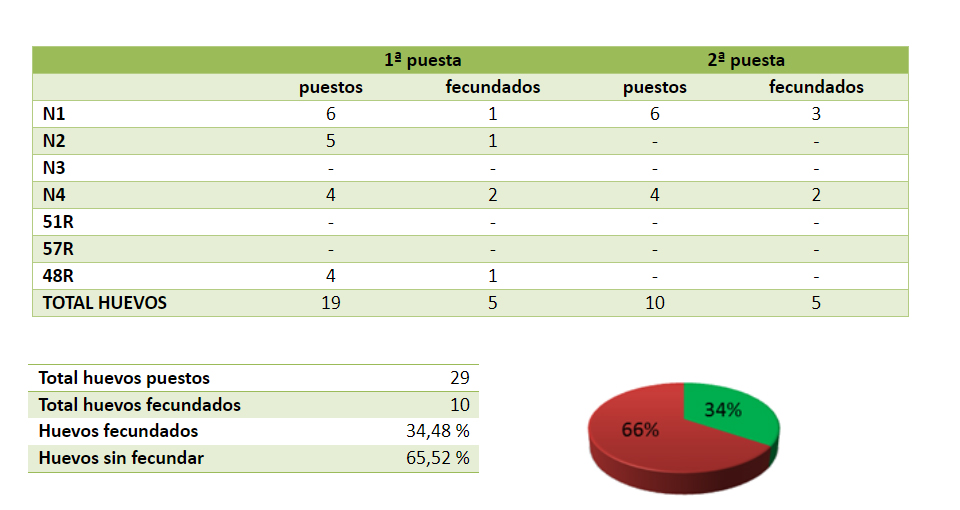
Tabla 2 – Inseminación antes del primer huevo
En algunas de estas inseminaciones, he inseminado a la hembra, de plumaje verde, con semen de 3 machos diferentes en distintos días previos a la postura. Los 3 machos tenían características hereditarias diferenciables. Uno con plumaje amarillo, otro con plumaje gris y el tercero con moña. La intención de esta prueba era ver con que fenotipo salían de los pichones, si alguno heredaba una característica marcada del padre, sabría cuál de las inseminaciones resultó ser la buena. Todos los pichones fueron verdes y sin moña, por lo que no he podido sacar conclusiones. Necesitarían una prueba de ADN, pero eso ya son palabras mayores, económicamente hablando, solo para averiguar este punto.
Variante 2
Llamaré variante 2 al proceso de dilución del semen.
Como compruebo la calidad del semen en cada inseminación, parte del semen recolectado lo necesito para meterlo en el porta muestras y verlo bajo el microscopio, por lo que se reduce la cantidad de líquido seminal.
La intención de diluir el semen es conseguir una mayor cantidad de líquido seminal, sabiendo que el número de espermatozoides de la muestra será el mismo. Lo que perseguí con esta variante era aumentar el líquido seminal para que los espermatozoides tuviesen más fluido en el que desplazarse por el oviducto y conseguir una mayor efectividad en la fecundación.
Como no soy científico, no tengo mucha idea de cómo diluir semen. Muy probablemente esa es la razón por la que no ha funcionado correctamente, en cuanto a fecundación de los huevos.
El proceso de dilución de semen es bastante complicado porque hay que tener varios factores en cuanta, pero principalmente hay que tener en cuenta el diluyente a utilizar y la temperatura de dilución. El diluyente que he utilizado es agua de coco al natural (muy económico), utilizado en inseminación de gallinas con un porcentaje de efectividad muy similar al diluyente comercial IMV (producto poco económico). El diluyente debe tener las propiedades de suministrar nutrientes a los espermatozoides y no matarlos. La temperatura de dilución también la hay que tener en cuenta, porque aunque se utilice un diluyente adecuado, el choque térmico, si la temperatura no es adecuada, puede matar a los espermatozoides.
El razonamiento que he utilizado para la dilución es que no hubiese mucha diferencia de temperatura entre semen y el diluyente a la hora de la mezcla. Para ello, mantenía una pipeta con agua de coco pegado a mi cuerpo para conseguir alrededor de 36ºC . Inseminaba a la hembra siguiendo el método general y a continuación dejaba caer un par de gotas de agua de coco sobre la vagina de la hembra como si fuese esperma, es decir, la dilución se producía en el interior de la hembra. De este modo, pretendía minimizar el choque térmico. Pero a tenor de los resultados (ver tabla 3) está claro que, o el diluyente no es adecuado, o/y la forma de hacerlo tampoco lo es. Pero he querido probar para ver cual era el resultado.
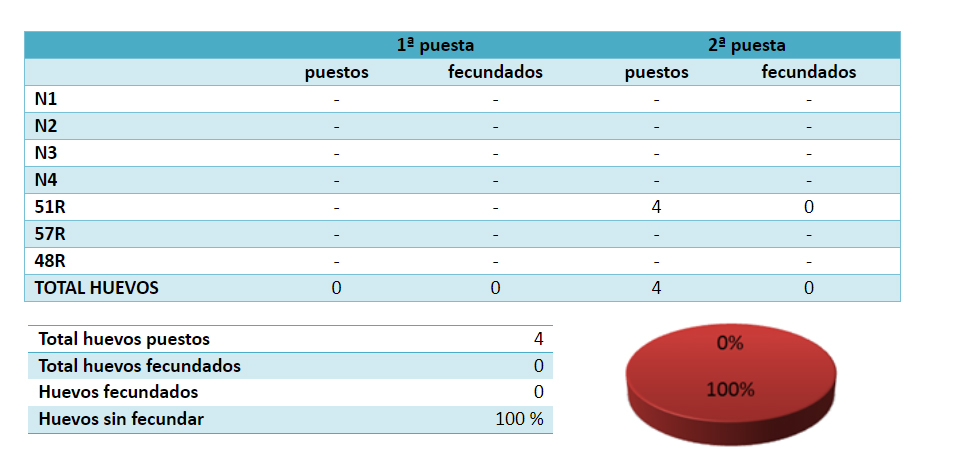
Tabla 3 – Inseminación antes del primer huevo con diluyente
Variante 3
Según he podido ver, en algunos documentos en la inseminación artificial de halcones, los criadores esperan a que la hembra ponga el primer huevo y antes de que transcurran 2 horas desde la puesta de ese primer huevo inseminan a la hembra. Con ello se aseguran fecundar el resto de los huevos que ponga la hembra. Pues apoyándome en este argumento de la inseminación de halcones he probado a ver el resultado.
Para ello he seguido el proceso del método general, pero en lugar de inseminar unos días antes de poner el primer huevo, he esperado a que la hembra pusiese el primer huevo, y antes de las 2 horas siguientes a la postura del huevo, inseminé a la hembra.
El resultado tampoco ha sido bueno, aunque solo lo he realizado en una ocasión y quizá no sea suficiente para valorar el resultado adecuadamente. Ver resultado en la tabla 4.
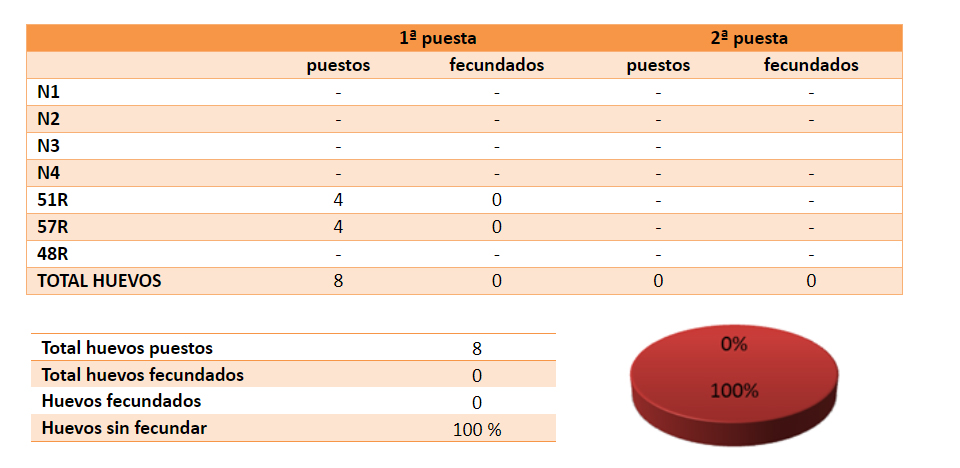
Tabla 4 – Inseminación tras el primer huevo
CONCLUSIÓN
La inseminación artificial en canarios es posible, hay que ser riguroso en seguir algunas pautas pero se puede conseguir relativamente fácil. Espero que con este documento les resulte más fácil a los criadores que, en un futuro, quieran intentarlo.
El porcentaje de efectividad es bajo comparado con la inseminación natural que supone la cópula de la pareja, pero estoy convencido de que los porcentajes de efectividad de la inseminación artificial se pueden mejorar. Desde mi experiencia la clave está en lograr introducir todo el esperma recolectado en el oviducto de la hembra. Cuando logremos introducir todo el semen recolectado al macho en el oviducto de la hembra, sin hacerle daño, los porcentajes de efectividad subirán considerablemente.
La cantidad de esperma es fácil de mejorar, basta con utilizar, en la inseminación, todo el semen recolectado, sin separar una parte para observar bajo el microscopio, ya que con la experiencia adquirida en este proceso un criador puede ser capaz de distinguir si una recolección de semen ha sido buena o mala nada más recolectarla. Por el comportamiento del macho, por el color de la muestra, y otras sensaciones que solo que adquieren con la práctica a través de la experiencia.
No todos los huevos fecundados artificialmente se convirtieron en canarios adultos, pero no he observado una mortalidad diferente en pichones o embriones conseguidos artificialmente, con respecto a los embriones o pichones conseguidos por cópula natural de la pareja de canarios.
Como he dicho anteriormente, los porcentajes de efectividad, en la inseminación artificial, no son muy altos, pero si un canaricultor se empeña en sacar una nidada por inseminación artificial, lo puede hacer perfectamente.
OTRAS IMÁGENES
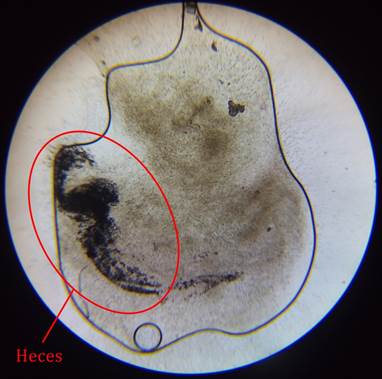
Imagen 14 – Población de espermatozoides contaminada con heces a 64 aumentos
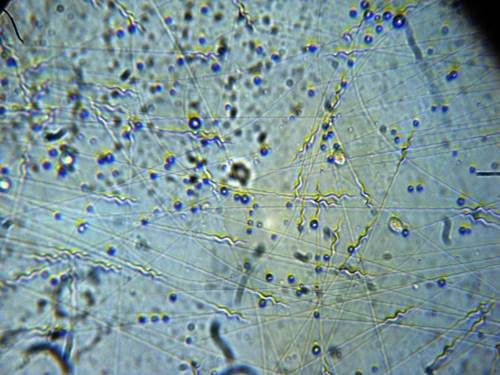
Imagen 15 – Espermatozoides a 460 aumentos
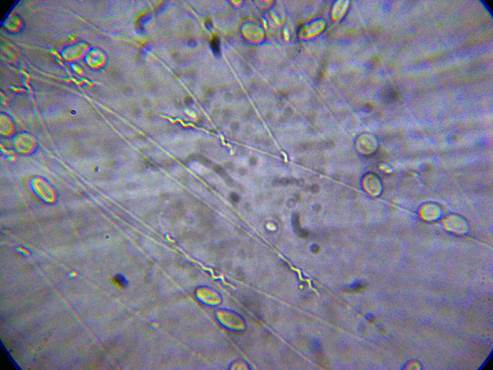
Imagen 16 – Espermatozoides y glóbulos rojos (sangre) a 460 aumentos

inseminacion artificial objetivo cumplido por Fabian M. Gerpe Meiras esta licenciado bajo una licencia Creative Commons Reconocimiento-NoComercial 4.0 Internacional License.